| Start | Informacje | Spis treści | Słownik | Przydatne adresy |
| 4.2 Fuzjonowanie protoplastów |
5.1 Zasady i cele transformacji genetycznej
Transformacją genetyczną nazywamy wprowadzanie niewielkiej porcji obcego DNA (z reguły obejmującej jeden lub kilka genów) do komórki-biorcy. Maksymalna wielkość przenoszonego fragmentu nie jest ostro ograniczona, ale przyjmijmy, że za transformację nie będziemy uważać wprowadzania do komórek całych genomów czy dużych ich fragmentów, tak jak to się dzieje podczas fuzji protoplastów (somatycznej hybrydyzacji), omówionej w poprzednim rozdziale. W naszym więc ujęciu fuzja protoplastów należy do zakresu inżynierii komórkowej, a nie genetycznej, transformacja natomiast jest najbardziej charakterystyczną techniką inżynierii genetycznej (choć jak zobaczymy w dalszej części tego rozdziału, obie dyscypliny powoli się do siebie zbliżają). W odróżnieniu od somatycznej hybrydyzacji, transformacja nie jest metodą krzyżowania, ale polega na stosunkowo drobnym modyfikowaniu organizmu przez uzupełnienie jego genomu, obejmującego zwykle kilkadziesiąt tysięcy genów, o ściśle określony gen lub kilka genów innych organizmów.
Pierwszymi organizmami które człowiek nauczył się transformować były bakterie (transformowane w połowie lat siedemdziesiątych ubiegłego wieku). Transformacja roślin została przeprowadzona po raz pierwszy w 1983 r (Monsanto - USA, Max-Planck-Institut fűr Zűchtungsforschung - Niemcy). Do dziś uzyskano transformację większości liczących się gospodarczo gatunków roślin uprawnych. Przy użyciu metod inżynierii genetycznej próbuje się nadawać roślinom wszelkie cechy, jakie uwarunkowane są obecnością jednego lub niewielkiej liczby genów - np.
- odporność na choroby, szkodniki, herbicydy, mróz, zasolenie
- wysoka wartość odżywcza (np. skład aminokwasowy poprawiony z uwzględnieniem wymagań żywieniowych człowieka), atrakcyjność smakowa i wizualna, trwałość (np. zahamowanie mięknięcia dojrzewających owoców)
- wytwarzanie nietypowych metabolitów i białek (np. peptydów działających immunizująco i pozwalających na wykorzystanie roślin jako doustnych szczepionek, biorozkładalnych plastyków itp.).
Obcy, czy - mówiąc bardziej fachowo - heterologiczny gen nazywamy transgenem, a komórki do których transgen został wprowadzony to transformanty. Organizmy zregenerowane (odtworzone) z transformowanych komórek nazywamy również transformantami, albo organizmami transgenicznymi, a czasami określamy je skrótem gmo (od ang. genetically modified organisms). Z reguły obcy gen, jakim jest transgen, nie jest przyjmowany w komórce bardzo obco i ulega wbudowaniu do genomu, po czym przekazywany jest potomstwu jak wszystkie pozostałe geny. Gdy transgen przyłączy się do jądrowego genomu komórki-biorcy (a nie do DNA mitochondrialnego lub plastydowego), to kodowana przez niego cecha dziedziczy się zgodnie z prawami Mendla (czytelnik/czka powinni się upewnić, że dobrze te prawa pamiętają http://www.rozanski.gower.pl/mendelizm2002.htm). Pierwotne transformanty, czyli organizmy zregenerowane z transformowanych komórek, a nie powstałe w wyniku rozmnażania płciowego, zachowują się pod względem właściwości kodowanych przez transgen jak heterozygoty. Żeby to zrozumieć warto sobie wyobrazić, że transgen (nazwijmy go np. genem T), włączony do któregoś chromosomu diploidalnej komórki-biorcy, ma w drugim z pary chromosomów homologicznych swój odpowiednik. Właściwie nie ma tam żadnej sekwencji homologicznej do transgenu, ale do dalszych wyliczeń wygodnie jest przyjąć, że jest tam allel "pusty" czy "zerowy", nie tworzący żadnego transkryptu i żadnego białka, czyli jak mówią genetycy allel typu "null" . Transgen wykazuje dominację w stosunku do swojego pustego allelu (oznaczmy go jako t). Jeśli roślinę będącą pierwotnym transformantem (i zawierającą tylko jedną kopię transgenu w przeliczeniu na hapoloidalną liczbę chromosomów) poddamy samozapyleniu to, zakładając że jej genotyp ma postać Tt, oczekujemy, że 3/4 jej potomstwa odziedziczy transgen (w jednej lub dwóch allelicznych kopiach, czyli będzie miało genotyp Tt lub TT), natomiast pozostałe organizmy potomne nie będą zawierać transgenu (będą homozygotyczne pod względem allelu null - będą miały genotyp tt). Tylko 1/4 wszystkich potomków będzie wiernie przekazywała następnym pokoleniom cechę uwarunkowaną przez transgen, a więc będzie stanowić homozygoty TT.
Jeśli z jakichś powodów nie dojdzie do integracji transgenu i pozostanie on jako "samotne" cytoplazmatyczne (episomalne) DNA, to w krótkim czasie zostanie rozłożony przez komórkowe enzymy nukleolityczne. Dlatego czasami chociaż po transformacji przez krótki czas (kilka do kilkudziesięciu godzin) obserwujemy aktywność (czyli ekspresję) transgenu, to później zanika ona zupełnie. Ekspresję taką nazywamy przejściową (ang. transient expression) i przeciwstawiamy ekspresji trwałej (stabilnej, ang. stable expression), wskazującej na wbudowanie transgenu do DNA komórki-biorcy.
W przypadku organizmów jednokomórkowych wbudowanie heterologicznego genu do genomu pojedynczej komórki oznacza zarazem powstanie zmodyfikowanego genetycznie organizmu. U wielokomórkowców natomiast, jeśli mówimy o organizmie transgenicznym, to zakładamy zwykle, że wszystkie jego komórki zawierają transgen. Nie istnieje jednak możliwość wprowadzenia DNA do każdej spośród nierzadko wielu milionów komórek organizmu wielokomórkowego. Możliwe jest natomiast zregenerowanie całego organizmu z transformowanej komórki. Do tego celu kultury in vitro okazują się niemal niezastąpione.
Choć samo przemieszczanie się DNA do komórki może zachodzić w czasie nie przekraczającym paru mikrosekund, to prace nad otrzymaniem nowych roślin transgenicznych trwają zwykle kilka lat i często łączą się w nich wysiłki różnych zespołów badawczych. Można wyróżnić następujące etapy prac nad doskonaleniem roślin metodami inżynierii genetycznej:
- Analizy agronomiczne, fizjologiczne, biochemiczne, genetyczne; powinny wyjaśnić jaką cechę warto nadać roślinie, w jaki sposób jest uwarunkowana (jedno- czy wielogenowo?), z jakich organizmów można pobrać odpowiedni gen czy geny, jakie mogą być skutki zdrowotne, ekologiczne, ekonomiczne i inne) takiej manipulacji
- Klonowanie genu/ów; istotą tego etapu prac jest otrzymanie genu jako oczyszczonego odczynnika, nadającego się do wszelkich badań i modyfikacji; na tym etapie uzyskuje się też podstawowe informacje o działaniu genu - odczytuje się jego sekwencję, bada się czynniki wpływające na jego ekspresję (w jakich warunkach i tkankach gen się uaktywnia? w jakim stopniu?)
- Przygotowanie konstruktów genowych; konstruktami genowymi nazywamy wszelkie cząsteczki DNA będące wynikiem
połączenia (ligacji) fragmentów różnych cząsteczek DNA i służące do doświadczeń (a więc sztucznie otrzymane);
kiedy eksperymentator otrzymuje sklonowany gen, to jest to zwykle cząsteczka DNA zawierająca promotor, część
kodującą i terminator danego genu, wbudowane do jakiegoś plazmidu (wektora klonującego); nie zawsze wektor
najodpowiedniejszy do powielania DNA jest też najodpowiedniejszym wektorem do transformacji. Podobnie promotor
i terminator, które dobrze działały w organizmie dawcy nie muszą być zupełnie odpowiednie w organizmie transgenicznym.
W związku z tym po sklonowaniu genu wycina się często wybrane jego fragmenty (np. część kodującą i terminator)
i łączy z odpowiednimi fragmentami innych cząsteczek DNA, na przykład promotorem innego genu. Stosunkowo często
zamienia się właśnie promotor, bo od niego zależy poziom aktywności genu i jej lokalizacja tkankowa, a ponieważ
eksperymentatorom często (przynajmniej we wczesnej fazie badań) zależy na tym żeby transgen był możliwie najaktywniejszy
i w możliwie najszerszym zakresie tkanek, często zamienia się promotor przenoszonego genu na bardzo silny promotor
konstytutywny (działający stale i praktycznie we wszystkich tkankach) jakim jest promotor CaMV35S, pochodzący z
wirusa mozaiki kalafiora. W niektórych wypadkach ważne jest jednak ścisłe ograniczenie zasięgu tkankowego ekspresji
transgenu. Na przykład jedna ze strategii nadawania roślinom cechy męskiej sterylności polega na wprowadzeniu do
nich genu kodującego pewną toksynę (właściwie enzym z grupy rybonukleaz zwany barnazą). Gen ten musi jednak uaktywniać
się tylko w komórkach pyłku, w przeciwnym razie zamiast roślin męskosterylnych eksperymentator otrzymałby rośliny
martwe (albo urojone). Poza genem, który ma nadać roślinom transgenicznym pożądane właściwości (nazwijmy go genem
użytkowym), do konstruktu wprowadza się zwykle także geny pełniące funkcje pomocnicze, ułatwiające szybkie rozpoznanie
transformantów i zmniejszające ryzyko regenerowania roślin mozaikowych, zawierających zarówno komórki transformowane
jak i nie transformowane. Nazywa się te pomocnicze odcinki DNA genami markerowymi. Wyróżnić można dwa rodzaje takich
genów: selekcyjne i reporterowe. Geny selekcyjne nadają komórkom zdolność do podziałów i regeneracji roślin na pożywce
zawierającej antybiotyk (zwykle kanamycynę lub higromycynę) lub herbicyd (zwykle preparaty Basta lub Round-up) i w
związku z tym toksycznej dla komórek dzikiego typu (nie transformowanych). Natomiast geny reporterowe, zwane też w
izualizującymi, powodują zmiany w wyglądzie i składzie chemicznym roślin - zwykle gromadzenie jakiegoś barwnika
(tak działa gen β-glukuronidazy czyli gus) lub świecenie (geny lucyferazy z bakterii - lux lub owadów świetlików -
luc, a także gen gfp zielono fluoryzującego białka z meduzy ), które pozwalają na wyszukanie transformantów na podstawie
oceny wzrokowej lub prostych testów biochemicznych (takim testem jest zwykle chromatografia cienkowarstwowa jako
metoda wykrywania aktywności genu cat (czytaj kat), kodującego acetylotransferazę chloramfenikolu - por. tabela 1).
Przygotowując konstrukt trzeba się również zastanowić nad planowaną metodą wprowadzenia go do komórek roślinnych, ponieważ w niektórych metodach wymagane jest wyposażenie transgenu w dodatkowe sekwencje pomocnicze. Konstrukt może też zawierać sekwencje sprzyjające wbudowaniu transgenu do odpowiedniego obszaru roślinnego genomu. Obudowanie transgenu sekwencjami homologicznymi do jakiegoś odcinka plastydowego DNA (zwykle dobiera się obszary międzygenowe) sprzyja wbudowaniu transgenu do plastomu (materiału genetycznego plastydów; odbywa się to na zasadzie wymiany podobnych fragmentów pomiędzy dwiema cząsteczkami DNA w procesie zwanym homologiczną rekombinacją). Tak otrzymywane są (choć z dużym trudem) rośliny zawierające transgeny w DNA plastydowym, zwane roślinami transplastomicznymi. Homologiczna rekombinacja pozwala też na adresowanie transgenów do odpowiednich obszarów jądrowego DNA, ale udaje się to jak dotąd tylko u mchu Physcomitrella patens. Nie wiadomo dlaczego rekombinacja homologiczna transgenów z jądrowym DNA praktycznie nie działa u innych roślin (uzyskiwano ją także u tytoniu i rzodkiewnika, ale ze znikomą częstością) - wygląda na to, że transgen wbudowuje się w nich "na chybił-trafił" w przypadkowych obszarach genomu (przynajmniej jeśli chodzi o wybór chromosomu i jego odcinka; zaznacza się jednak tendencja do częstszego wbudowywania się transgenów do obszarów DNA o wysokiej aktywności transkrypcyjnej). Czasami w skład konstruktu wchodzą też elementy ułatwiające usunięcie genów markerowych z roślin transgenicznych (po spełnieniu swojej funkcji geny te są zbędne, a jeśli warunkują odporność na antybiotyki, mogą być nawet uważane za szkodliwe).
Tabela 1.Geny reporterowe stosowane w inżynierii genetycznej
* Autoradiogram przedstawia trzy formy acetylowanego chloramfenikolu rozdzielone podczas chromatografii cienkowarstwowej (Cm-chloramfenikol, Ac-reszta acetylowa, K-kontrola, PW-próba właściwa posiadająca gen cat)Gen
Białko - produkt genu
Pochodzenie genuKatalizowana reakcja Metoda analizy Obraz ekspresji GUS (uidA)
Escherichia colihydroliza glukuronidów np.: X-Gluc spektrofotometryczna, fluorymetryczna, histochemiczna 
niebieski barwnikLUC (luc)
lucyferaza
Photinus pyralisUtlenianie lucyferyny zależne od ATP; towarzyszy mu emisja światła luminometryczna, fotoluminescencyjna 
żółto-zielone świecenie własnym światłemGFP (gfp)
Białko zielono fluoryzujące
Aequorea victoriaProces fluorescencji fluorymetryczna, mikroskopia fluorescencyjna zielone świecenie obiektów oświetlonych niebieskim lub nadfioletowym światłem CAT (cat)
acetylotransferaza chloramfenikolu
Escherichia coliAcetylacja chloramfenikolu chromatografia ciekowarstwowa, autoradiografia, spektofotometryczna, densytometryczna, 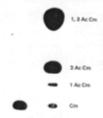
pojawienie się produktów acetylacji antybiotyku na chromatogramie (a dokładniej na autoradiogramie)*
- Wprowadzenie genu do komórek/protoplastów; ten zabieg stanowi właściwą istotę transformacji genetycznej i zostanie dokładnie omówiony w następnym podrozdziale. Zaznaczamy jednak od razu, że metody transformacji zwykło dzielić się na wektorowe (pośrednie) i bezwektorowe (bezpośrednie). Do metod wektorowych zalicza się transformację przy pomocy Agrobacterium tumefaciens, A. rhizogenes i roślinnych wirusów; przez wektory do transformacji rozumiemy czynniki ułatwiające wprowadzanie DNA do komórek takie jak właśnie bakterie i wirusy; w przypadku bakterii określenie bywa stosowane w odniesieniu do całych bakteryjnych komórek albo ich plazmidów (bakterie w tej metodzie właściwie pozostają poza komórką roślinną, a do jej wnętrza posyłają jedynie fragment swojego plazmidu). Wśród metod bezpośredniej (bezwektorowej) transformacji roślin, największe znaczenie zdobyło użycie tzw. armatki genowej (zwanej też strzelbą genową) czyli metoda biolistyczna. Nieco rzadziej wykorzystuje się transformację protoplastów wspomaganą wyładowaniami pola elektrycznego (elektroporację) lub chemiczną transformację, w której przenikanie DNA przez błony pobudzane jest działaniem odpowiednimi odczynnikami, a zwłaszcza glikolem polietylenowym lub wykorzystuje się DNA ukryty w liposomach. Do metod transformacji bezpośredniej roślin powszechnie znanych, choć rzadko wykorzystywanych w praktyce należy mikroiniekcja, czyli wstrzykiwanie DNA do wnętrza komórki lub nawet jądra komórkowego przy pomocy mikromanipulatora i odpowiedniej mikropipety. W podrozdziale 5.4 przedstawiamy też kilka przykładów metod transformacji, których praktyczna przydatność jest na razie dyskusyjna, niepewna.
- Selekcja i regeneracja roślin; części roślin poddane transformacji z reguły wykorzystywane są jako eksplantaty do hodowli in vitro i regeneruje się z nich rośliny; każda technika stosowana do mikrorozmnażania roślin może znaleźć tu zastosowanie. Zazwyczaj regeneracja transformantów łączona jest z selekcją, a więc stwarzane są warunki (dodawane są do pożywki substancje) które powodują, że tylko komórki transformowane są w stanie dzielić się i odtwarzać rośliny. Znacznie rzadziej regeneruje się najpierw możliwie największą liczbę roślin, przenosi się je do warunków ex vitro, a dopiero potem opryskuje się je herbicydem jako czynnikiem selekcyjnym. Jeśli selekcja jest niezbyt skuteczna, to mogą rozwinąć się organizmy mozaikowe, zbudowane zarówno z komórek transformowanych jak i nietransformowanych. Efektu mozaikowatości i związanej z tym nieprzewidywalności dziedziczenia genu można uniknąć zbierając z badanej rośliny nasiona. Wszystkie komórki rozwijającego się w nasieniu zarodka są wynikiem podziałów mitotycznych zygoty, a więc są potomstwem tej samej komórki i mają ten sam genotyp. Efekt mozaikowatości zanika więc w następnym pokoleniu rozmnażanych generatywnie roślin (w przypadku roślin transformowanych nazywanym pokoleniem T1). Oczywiście mówiąc o jednorodności genetycznej komórek somatycznych wielokomórkowego organizmu, abstrahujemy dla uproszczenia od efektów, jakie są sporadycznie wywołane działaniem ruchomych elementów genetycznych - transpozonów) i mutacji.
- Analizy genetyczno-molekularne (ryc. 1) - wyjaśniają czy nastąpiło trwałe wbudowanie transgenu, w ilu kopiach, czy transgen wykazuje ekspresję zgodną z oczekiwaniami, czy rośliny są wolne od Agrobacterium (jeśli używano go do transformacji) i nie zawierają niepożądanych fragmentów DNA; czy nie wystąpiły modyfikujące efekty zmienności somaklonalnej?
- Klasyczne prace hodowlane, obejmują samozapylenie transformantów, poszukiwanie roślin homozygotycznych pod względem transgenu, analiza częstości dziedziczenia transgenu, porównanie fenotypów; ewentualnie krzyżowanie z innymi liniami genetycznymi rośliny w celu otrzymania wartościowych odmian, ewentualne usuwanie genów selekcyjnych. Przeprowadzana jest analiza prawdopodobnych skutków uwolnienia otrzymanych organizmów, występuje się o zgodę na ich uwolnienie (minister ds. środowiska), w końcu przeprowadza się doświadczenia polowe.

| 5.2 Transformowanie roślin przy pomocy Agrobacterium tumefaciens lub A. rhizogenes |