| Start | Informacje | Spis treści | Słownik | Przydatne adresy |
| 2.3.3 Etapy procesu krioprezerwacji |
3.2.4 Metody krioprezerwacji
Opisano dotychczas co najmniej cztery typy procedur krioprezerwacji: metoda kontrolowanego tempa zamrażania, metoda zeszklenia (witryfikacji), metoda mrożenia odwodnionego materiału otoczkowanego (ang. encapsulation/dehydration) i metoda witryfikacji materiału otoczkowanego (ang. encapsulation/vitrification). Poniżej przedstawiamy skrótową charakterystykę tych metod.
a.) metoda kontrolowanego tempa zamrażania
Nazywana jest także wolnym mrożeniem lub zamrażaniem dwustopniowym. Składa się z dwóch faz:
Faza I –odpowiednio przygotowany (przy pomocy zestawu krioprotektantów) materiał biologiczny ochładzany jest do temperatury -30°, -40°C w starannie kontrolowanym tempie (0,2-1°C/min)
Faza II – przeniesienie ochłodzonego materiału do ciekłego azotu (zakłada się, że materiał ochłodzony do ok. -40°C zniesie już dalsze gwałtowne ochłodzenie).
Dużym mankamentem tej metody jest stosunkowo wysoka cena programowanych zamrażarek umożliwiających dokładne kontrolowanie szybkości ochładzania.
b.) witryfikacja
Jest to metoda jednostopniowa, która polega na zamrażaniu materiału biologicznego przez bezpośrednie zanurzenie w ciekłym azocie. Istotą witryfikacji (zeszklenia) jest przejście komórkowych roztworów z postaci cieczy przechłodzonej w stan „szkła” (bezpostaciowy = amorficzny stan przypominający strukturą szkło), bez tworzenia się kryształów lodu.
W celu uzyskania witryfikacji (w użytym tu sensie, nie w znaczeniu nadmiernego uwodnienia tkanek roślinnych!) można stosować bardzo wysokie stężenia substancji ochronnych, lub nawet ultraszybkie ochładzanie bez użycia krioprotektantów (105°C/min; oczywiście nie oznacza to wcale, że po minucie tkanka ochłodzi się do -100 000°C – taki pomysł strasznie rozgniewałby fizyków! - a jedynie, że ochłodzenie się od +20°C do -196°C zajmie jej zaledwie około 15 milisekund). Najczęściej łączy się działanie środków ochronnych z umiarkowanie szybkim schładzaniem (10-2000°C/min). Wysokie stężenia składników roztworu witryfikacyjnego powodują, że działa on toksycznie na komórki, tym bardziej, że jego część wnika do wnętrza komórek. W związku z tym ważne jest by inkubację w roztworze krioprotektantów przeprowadzać dwuetapowo, jak to zaznaczono w podrozdziale nr 3.2.3 tego rozdziału.
c.) mrożenie odwodnionego materiału otoczkowanego
Materiał (zwłaszcza merystemy wierzchołkowe pędów) zamknięty w kulkach z alginianu z dodatkiem soli mineralnych (np. 50% MS), sacharozy i glicerolu inkubuje się przez kilkanaście godzin przy temperaturze pokojowej w stężonym roztworze sacharozy i glicerolu (odpowiednio 0,8M i 0,5M), po czym osusza się inkubując przez kilka godzin nad suchym żelem krzemionkowym; następnie materiał zamrażany jest przez zanurzenie w ciekłym azocie.
d.) witryfikacja odwodnionego materiału otoczkowanego
Materiał kapsułkowany (= otoczkowany) w kulkach alginianu, jak wyżej, inkubowany jest przez kilkadziesiąt minut w roztworze stężonych krioprotektantów (np. PVS2 = 3,2M glicerol (=30%), + 2,42 M glikol etylenowy (= 15%)+ 1,92 M DMSO (= 15%) w 0,4 M sacharozie (13,7%) o pH 5,8); następnie kapsułki z materiałem przenoszone są do ciekłego azotu.
Skuteczność procesu krioprezerwacji ocenia się na podstawie obserwacji wzrostu komórek, oznaczenia ich świeżej bądź suchej masy lub pomiaru aktywności biochemicznej komórek (np. określenie ilości ATP, DNA, białka, aminokwasów), a także stosując standardowe metody oznaczania żywotności komórek, omówione w rozdziale poświęconym hodowlom zawiesinowym. Bardzo miarodajnym wskaźnikiem efektywności metody przechowywania materiału roślinnego jest wydajność regeneracji roślin z tego materiału. Parametr ten nie zawsze jest jednak podawany w publikacjach, ponieważ jego wyznaczenie wymaga zwykle sporo czasu (kilku miesięcy). W skutecznych metodach krioprezerwacji ponad 50% eksplantatów pobranych z rozmrożonego materiału odtwarza rośliny.
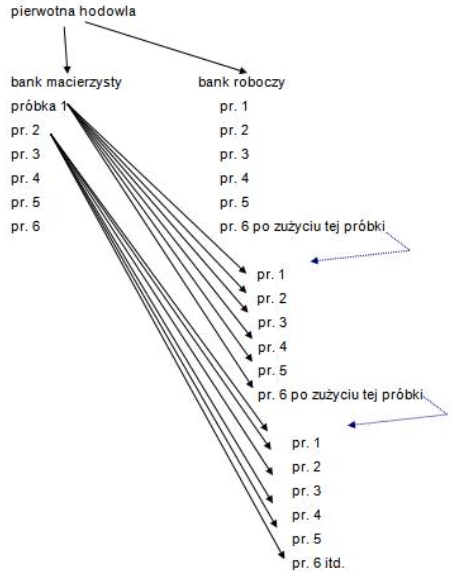
W krioprezerwacji ważne jest nie tylko umiejętne zamrażanie i rozmrażanie materiałów biologicznych, ale także planowe i rozsądne gospodarowanie zgromadzonymi zasobami. W związku z tym zaleca się stosowanie systemu serii posiewowych (ang. seed lot system), opracowanego pierwotnie głównie dla szczepów drobnoustrojów wykorzystywanych w przemyśle farmaceutycznym (ryc.). Z pierwotnej hodowli pobiera się do przechowywania dwa rodzaje materiału: macierzysty bank komórek (ang. master cell bank), złożony z kilku naczyń (kilku powtórzeń) oraz roboczy bank komórek (ang. working cell bank), również utworzony przez kilka próbek zamrożonego materiału (w naczyniach kriogenicznych o pojemności paru ml); ważne jest, by wszystkie próbki składające się na bak macierzysty i roboczy były możliwie identyczne. Następnie, w miarę potrzeby, zużywa się tylko próbki składające się na roboczy bank komórek, nie naruszając żelaznej rezerwy w postaci banku macierzystego. Gdy ostatnia z próbek składających się na roboczy bank komórek zostanie zużyta, pobiera się tylko jedną próbkę z banku macierzystego, komórki poddaje się namnożeniu i sporządza się kolejną serię próbek składających się na nowy bank roboczy. Znowu do wszelkich doświadczeń wykorzystuje się tylko próbki z banku roboczego, a gdy zostanie zużyta ostatnia z nich, pobiera się znowu tylko jedną próbkę z banku macierzystego i wykorzystuje ją do założenia następnej posiewowej serii roboczej. W ten sposób przez bardzo długi czas badacz dysponuje próbkami pobranymi z pierwotnej hodowli (pozostającymi w banku macierzystym). Zaleca się by niektóre próbki przechowywanego materiału umieścić w innym pomieszczeniu niż właściwy bank macierzysty i roboczy, dzięki czemu zmniejsza się ryzyko utraty całości materiału w wyniku katastrof, awarii czy jakichkolwiek innych nieprzewidywalnych okoliczności. Ważne jest też systematyczne i poglądowe zapisywanie rozmieszczenia wszystkich próbek, tak by w miarę potrzeby łatwo było do nich dotrzeć i by zminimalizować ryzyko pomyłek.
Lektura uzupełniająca:
Plant cryopreservation: a practical guide – (red.) Barbara M. Reed - 2008 (dostępne w serwisie Google Books)
www.nalgenelabware.com/techdata/Technical/cryo.pdf (Cyopreservation Manual - Nalge Nunc International, 1998)
| 2.4 Uwalnianie roślin od patogenów przy pomocy kultur in vitro |