| Start | Informacje | Spis treści | Słownik | Przydatne adresy |
| 6.4 Sprzęt do prowadzenia kultur zawiesinowych |
6.5 Ocena jakościowa i ilościowa kultur zawiesinowych
Przez pierwsze dwa - trzy tygodnie prowadzona jest hodowla wstępna. W tym okresie należy ze szczególną uwagą sprawdzać czy hodowla nie brunatnieje (co może być spowodowane utlenianiem komórkowych fenoli, a powstające toksyczne związki powodują zamieranie hodowli) i czy nie pojawia się mleczne zmętnienie, co może być oznaką zakażenia.
Wszystkie manipulacje w hodowlach komórkowych muszą być przeprowadzane ze szczególną starannością ze względu na dużą podatność zawiesiny na zakażenia, spowodowaną następującymi czynnikami:
- koniecznością przeszczepiania znacznie częstszego niż w hodowlach na stałych pożywkach,
- ułatwionym szybkim rozprzestrzenieniem się drobnoustroju w całej objętości hodowli w płynnej pożywce
- składem pożywek bogatym w związki organiczne, co ułatwia rozwój mikroorganizmów.
Zakażenie może objawiać się zmętnieniem pożywki (głównie w przypadku bakterii) lub - w przypadku pleśni - pojawieniem się watowatych strzępek. Zakażone hodowle można jednoznacznie rozpoznać posiewając niewielkie ich ilości na podłoża mikrobiologiczne. W niektórych przypadkach udaje się uratować zakażoną hodowlę dodając do niej odpowiedni antybiotyk lub fungicyd. Najczęściej jednak zakażone hodowle muszą być po prostu usunięte.
Do dalszej hodowli pobiera się możliwie jednorodną zawiesinę, oddzielając ją od resztek eksplantatu przez sączenie przez jałowe sitka. Pasaże prowadzone są zwykle co jeden do dwóch czy trzech tygodni. Podczas pierwszych pasaży stosuje się niewielkie rozcieńczenia inoculum (do 4 x). W okresie późniejszym, kiedy otrzymamy tzw. ustaloną zawiesinę, charakteryzującą się intensywnym i powtarzalnym w kolejnych pasażach przyrostem komórek, stosujemy rozcieńczenia ok. dziesięciokrotne.
W ocenie stanu zawiesiny pierwszorzędne znaczenie ma określenie szybkości namnażania komórek i ich zagęszczenia. W tym celu można po prostu policzyć komórki w próbce zawiesiny, wykorzystując do tego mikroskop i hemocytometr (szkiełko mikroskopowe z naniesioną siatką linii, przeznaczone głównie do liczenia krwinek). Zastosowanie hemocytometru jest nieco utrudnione przez fakt, że komórki roślinne są na ogół znacznie większe od krwinek, a poza tym jak już wspomniano, mogą tworzyć wielokomórkowe agregaty. W celu możliwie dokładnego policzenia komórek agregaty należy rozbić. Częściowo można to uzyskać pompując zawiesinę wielokrotnie pipetą lub strzykawką. W przypadku większych i bardziej spoistych agregatów konieczna może być maceracja chemiczna przy pomocy kwasu chromowego (20%) lub solnego (1 - 5 M) z ogrzewaniem na łaźni wodnej (60°C, 30 min) trójchlorooctowego (50%, w temp. pokojowej, do 30 min) lub enzymatycznie przy pomocy pektynazy i celulazy (37°C, kilka godzin). W podanych warunkach zwykle nie uzyskuje się całkowitego rozpadu agregatów, ale w drobnych skupiskach złożonych z kilku komórek można je już łatwo policzyć. Ze względu na to, że oznaczanie liczby komórek jest czynnością praco- i czasochłonną, coraz częściej stosuje się parametr uproszczony w postaci liczby jednostek (UN) na 1 cm3, a za jednostkę przyjmuje się zarówno pojedyncze komórki jak i agregaty. Jest to jednak wskaźnik mniej dokładny i wymaga ustalenia średniej liczby komórek na jednostkę. O liczbie komórek w zawiesinie można też wnioskować na podstawie parametrów pomocniczych, takich jak:
- świeża masa; zawiesina sączona jest przez filtr, który został wcześniej zważony, albo poddawana wirowaniu w zważonej wcześniej probówce wirowniczej; czasami dodatkowo oznacza się zawartość białka w masie komórek lub objętości hodowli
- sucha masa - komórki suszy się do stałej masy w temp. 70 - 120°C
- całkowita objętość komórek (ang. packed cell volume; PCV) - określoną objętość zawiesiny, na przykład 10 ml, wiruje się delikatnie w kalibrowanych porbówkach (300 g x 5 min), a następnie odczytuje objętość jaką zajmują komórki (zwykle wyrażając ją w % objętości zawiesiny)
- objętość komórek po sedymentacji (ang. sedimented cell volume; SCV) - kolby z hodowlami odstawiane są na krótki czas (np. 15 minut) w bezruchu, lekko pochylone (60°), a potem odczytana jest na odpowiedniej skali objętość osadu (wyraża się ją zwykle w % objętości zawiesiny).
Do liczenia komórek w zawiesinie można także wykorzystać urządzenia automatyczne, takie jak licznik Coultera i cytometr przepływowy. Licznik Coultera stosowany jest głównie w analizach hematologicznych, a jego wykorzystanie w biotechnologii roślin opisywano dość sporadycznie. Urządzenie wykrywa zmiany oporu elektrycznego pomiędzy dwiema elektrodami omywanymi strumieniem słabego elektrolitu, w którym zawieszone są zliczane komórki. Pojawienie się komórki pomiędzy elektrodami powoduje chwilowy wzrost oporu. Takie elektryczne impulsy zliczane są przez komputer. Urządzenie pozwala nie tylko na oznaczanie liczby komórek, ale także ich objętości (wzrost oporu jest tym większy im większa jest objętość komórki).
Znacznie częściej wykorzystuje się do liczenia komórek cytometrię przepływową. Technika ta opiera się na pomiarach fluorescencji komórek lub ich składników wybarwionych odpowiednimi znacznikami - fluorochromami. Praktycznie każda technika cytochemiczna oparta na pomiarach fluorescencji może być zastosowana do cytometrii przepływowej. Metoda pozwala na zliczanie pojedynczych komórek lub ich składników przepływających w laminarnym (niezaburzonym) strumieniu cieczy nośnej. Odległość, na której przeprowadzany jest pomiar, pojedyncza komórka pokonuje w ciągu 1 do 50 mikrosekund, w zależności od budowy aparatu. Impulsy odbiera odpowiedni detektor (lub fotodetektory) i przekazuje sygnał do elektronicznych układów analizujących. W ciągu sekundy urządzenie może wykryć ponad tysiąc komórek. Cytometria przepływowa bywa stosowana także do oznaczania zawartości DNA w komórkach (a na tej podstawie stopnia ich ploidalności). Poza urządzeniami typowo analitycznymi, istnieją również cytometry przepływowe sortujące, które pozwalają na szybkie segregowanie komórek zależnie od ich zdolności do barwienia się różnymi fluorochromami (krople cieczy nośnej zawierające komórki otrzymują ładunek elektryczny, dobrany zależnie od ich fluorescencji i w ten sposób kierowane są do jednego z kilku naczyń odbiorczych).
Dzięki ułatwionemu pobieraniu składników odżywczych, w kulturach zawiesinowych podziały komórek następują z dużą szybkością i przyrosty biomasy są większe niż na pożywkach agarowych. W hodowli okresowej wyraźnie zwiększające się zagęszczenie komórek prowadzi do stopniowych zmian warunków hodowli - zmniejsza się dostępność składników pokarmowych, a nagromadzają się metabolity uwalniane przez komórki. Zmiany te znajdują odbicie w częstości podziałów komórek, która wykazuje wyraźną okresowość. Odkładając na osi odciętych czas, a na osi rzędnych zagęszczenie komórek lub powiązane z nim parametry pomocnicze (mierzone zwykle co 2-3 dni) otrzymujemy krzywą wzrostu.
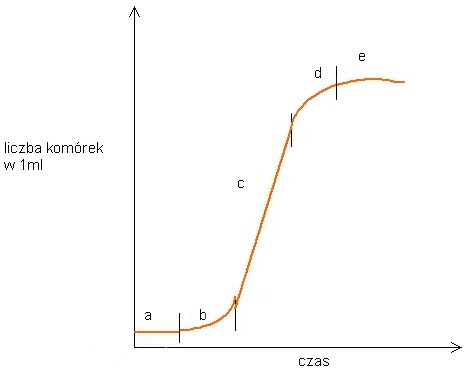
W przebiegu typowej krzywej wzrostu zawiesiny hodowanej w systemie okresowym wyróżnić można 5 faz:
- spoczynkową - przyrost liczby komórek jest minimalny ze względu na efekt silnego rozcieńczenia inoculum świeżą pożywką; przygotowanie do podziałów
- wykładniczą - częstość podziałów wyraźnie wzrasta, zagęszczenie komórek jest jeszcze niewielkie, ale szybko się zwiększa; przyrosty liczby komórek na jednostkę czasu są coraz większe
- liniową - częstośc podziałów jest w przybliżeniu stała, a liczba komórek wzrasta w jednostajnym tempie - liniowo
- obniżonego tempa wzrostu - liczba komórek zbliża się do maksimum, a częstość podziałów zaczyna się obniżać
- stacjonarną - liczba komórek utrzymuje się na stałym poziomie lub spada, podziały komórek ustają.
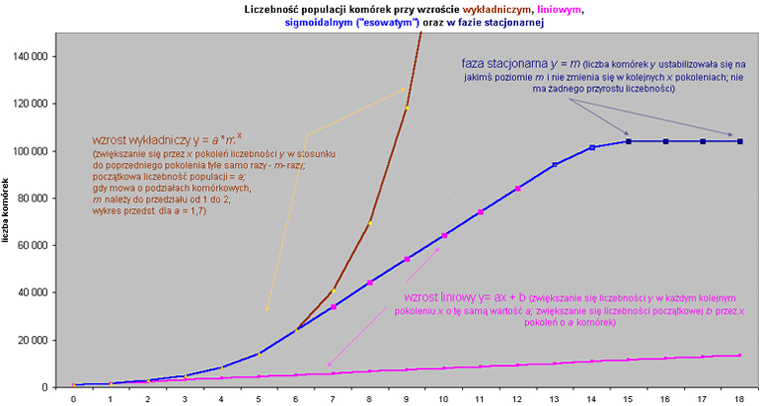
| pokolenia, czas -> | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
 wzrost liniowy wzrost liniowywzrost wykładn. wzrost sigmoidalny faza stacjonarna |
1000 1000 1000 |
1700 1700 1700 |
2400 2890 2890 |
3100 4913 4913 |
3800 8352 8352 |
4500 14199 14199 |
5200 24138 24199 |
5900 41034 34199 |
6600 69758 44199 |
7300 118588 54199 |
8000 201599 64199 |
8700 342719 74199 |
9400 582622 84199 |
10100 990458 94199 |
10800 1683778 101400 |
11500 2862423 104199 104199 |
12200 4866119 104199 104199 |
12900 8272403 104199 104199 |
13600 14063084 104199 104199 |
Na podstawie krzywej wzrostu określa się czas podwojenia populacji (ang. doubling time; DT; zwykle wynosi od kilku godzin do kilku dni), jak również ustala najodpowiedniejszy moment do przeszczepienia (pasażowania) zawiesiny lub pobrania próbek do doświadczeń, np. zawiesinę komórek tytoniu linii BY-2 przeszczepia się co 7 dni (co pozwala na utrzymanie dużego tempa podziałów przy ograniczeniu liczby pasaży), a do doświadczeń dotyczących reakcji komórek na stres pobiera się materiał już z 5-6 dniowych hodowli (co zapewnia możliwie najlepszy stan fizjologiczny wyjściowego materiału). Ogólnie zaleca się zwykle pasażowanie zawiesiny pod koniec fazy obniżonego tempa wzrostu lub na samym początku fazy stacjonarnej. Czasami oznacza się średni czas generacji - okres między kolejnymi podziałami komórek; wymaga to jednak użycia hodowli komórek dzielących się synchronicznie i zastosowania metod izotopowych, stąd nie jest to analiza przeprowadzana rutynowo.
Przy mniejszej gęstości wyjściowej zawiesiny i większym rozcieńczeniu inoculum faza spoczynkowa wydłuża się. Nie wszystkie wskaźniki wzrostu zawiesiny dają identyczny obraz zmian. Największy przyrost objętości i świeżej masy komórek może następować w fazie stacjonarnej, kiedy liczba komórek przestaje wzrastać.
Poza szybkością wzrostu zawiesiny interesująca jest także cytofizjologiczna charakterystyka komórek w hodowli, która może być oparta na wyznaczeniu następujących parametrów:
- średnia wielkość komórek (PCV/CN = stosunek całkowitej objętości komórek do ich liczby)
- indeks mitototyczny MI = liczba komórek w stadium mitozy/ całkowita liczba analizowanych komórek x 100%; zawiesina musi być utrwalona i barwiona; zwykle wynosi do kilkunastu %
- liczba chromosomów; ważna ponieważ podczas hodowli może następować zmiana ploidalności komórek; jeśli ponad 50% komórek ma stałą i określoną liczbę chromosomów to wartość tę przyjmujemy jako wskaźnik ploidalności całej hodowli; im bardziej wyrównane pod względem ploidalności są komórki, tym bardziej stabilna genetycznie jest zawiesina; pośrednio można o tym samym wnioskować oznaczając zawartość DNA w komórkach (metoda cytofotometryczna)
- stopień agregacji komórek - średnia liczba komórek w agregacie komórkowym
- żywotność komórek; określana na podstawie
- ogólnej aktywności dehydrogenaz (testu tetrazolowego) - komórki zawiesza się w roztworze czterochlorku trójfenylotetrazolowego i mierzy się szybkość powstawania czerwonego produktu utlenienia tej substancji przez komórkowe enzymy (produkt, zwany formazanem, można rozpuścić w acetonie i zmierzyć jego stężenie kolorymetrycznie)
- testu aktywności esteraz - komórki barwione są dwuoctanem fluoresceiny (lub podobnymi barwnikami, np. kalceiną), który pod wpływem esteraz uwalnia fluoresceinę, nadającą komórkom (zawierającym aktywny enzym, a więc żywym) zieloną fluorescencję; częściowo ten test mierzy też integralność (szczelność) błon, bo jeśli błony komórkowe są uszkodzone, to komórki szybko tracą fluoresceinę i związaną z nią fluorescencję
- testu integralności błon - komórki barwione są błękitem Evansa (żywe komórki opierają się napływowi do ich wnętrza barwnika, a komórki z uszkodzonymi błonami barwią się na niebiesko)
- obserwacji w mikroskopie kontrastowo-fazowym - widoczne ruchy cytoplazmy po mostkach cytoplazmatycznych typowe są dla żywych komórek (jakkolwiek stres może silnie pobudzać te ruchy); widoczna czasem plazmoliza jest typowa dla komórek przechodzących apoptozę (zaprogramowaną śmierć); nekroza - śmierć nie związana z uruchomieniem komórkowego mechanizmu samozagłady nie objawia się plazmolizą
- oceny wydajności wysiewu komórek (ang. plating efficiency) - komórki wysiewane są cienką warstwą w płytce Petriego, na powierzchni agarowej pożywki, albo wymieszane z ostudzoną pożywką agarową, przed jej zastygnięciem; pożywka ma zwykle skład taki jak dla zawiesiny, tyle że jest zestalona; ocenia się liczbę i wielkość wytworzonych kolonii w stosunku do liczby wysianych komórek (wyraża się w %; sięga 50%; czasami w uproszczeniu ocenia się plon wysiewu, czyli liczbę kolonii na płytce, bez liczenia wyjściowej liczby komórek; oczywiście ten parametr jest znacznie mniej miarodajny); metoda ta pozwala też na dobranie optymalnej gęstości wysiewu; im lepiej dobrana pożywka dla danego typu komórek, tym mniejsza jest wymagana gęstość wysiewu; w tej samej zawiesinie mogą występować komórki i agregaty komórkowe wyraźnie różniące się wydajnością wysiewu.
Zwiększeniu jednorodności hodowli służy frakcjonowanie komórek. W najprostszej wersji pasażuje się zawiesinę, pobierając najwyższą jej warstwę, po tym jak przez kilka minut była pozostawiona w bezruchu i najcięższe agregaty opadły na dno. Precyzyjniejsze jest sączenie zawiesin przez metalowe lub plastikowe, sterylne sitka o dokładnie znanej wielkości oczek, albo ultrawirowanie różnicowe (w gradiencie sacharozy albo Percolu). Frakcjonowanie komórek pozwala osiągnąć częściową ich synchronizację co do fazy cyklu komórkowego. Pełniejszą synchronizację osiąga się przez okresowe głodzenie hodowli, powodujące, że wszystkie komórki dochodzą do pewnego etapu cyklu komórkowego i pozostają w tej fazie, ponieważ nie są w stanie przejść do następnego etapu cyklu bez brakującego im składnika pożywki. Potem ponownie wprowadza się tę substancje do pożywki, albo przenosi komórki do świeżej pożywki i wszystkie komórki, które tylko na tę okazję czekały przystępują do następnego etapu cyklu mitotycznego. Opisywano synchronizowanie komórek przez głodzenie ich pod względem auksyn, cytokinin, jonów fosforanowych albo azotu. Na przykład brak 2,4-D w pożywce utrzymywał komórki tytoniu i marchwi w fazie G1. Inną metodą synchronizacji jest użycie inhibitorów syntezy DNA, takich jak 5-aminouracyl, tymidyna (w dużym stężeniu), hydroksymocznik. Po pewnym okresie działania inhibitora, komórki są zebrane (sączenie lub wirowanie), przepłukane świeżą pożywką i zawieszone w takiej pożywce (oczywiście już bez inhibitora). Powoduje to, że wiele komórek jednocześnie wkracza w fazę S cyklu mitotycznego.
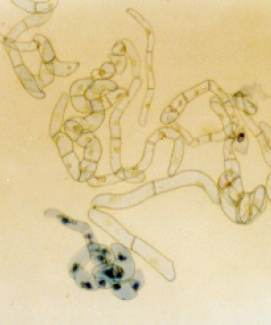
Zauważ, że tę zawiesinę tworzą drobne agregaty złożone z kilku komórek;
w dolnej części fotografii widać silnie chłonące barwnik komórki martwe lub uszkodzone
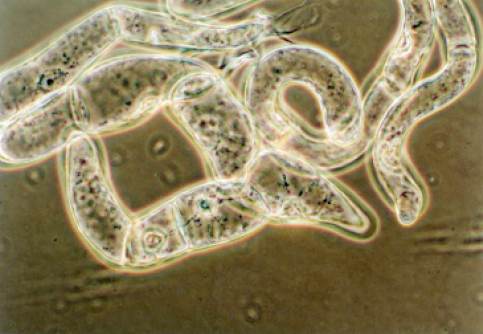
zwróć uwagę na widoczne w dolnej części fotografii jądra komórkowe i zbiegające się ku nim mostki cytoplazmatyczne,
po których odbywa się krążenie cytoplazmy
| 6.6 Mikrohodowle. Bibułowe tratwy, warstwy odżywcze, mikrokomory |