| Start | Informacje | Spis treści | Słownik | Przydatne adresy |
| 5.3 Transformacja przy pomocy wirusów |
5.4 Transformacja biolistyczna (mikrowstrzeliwanie)
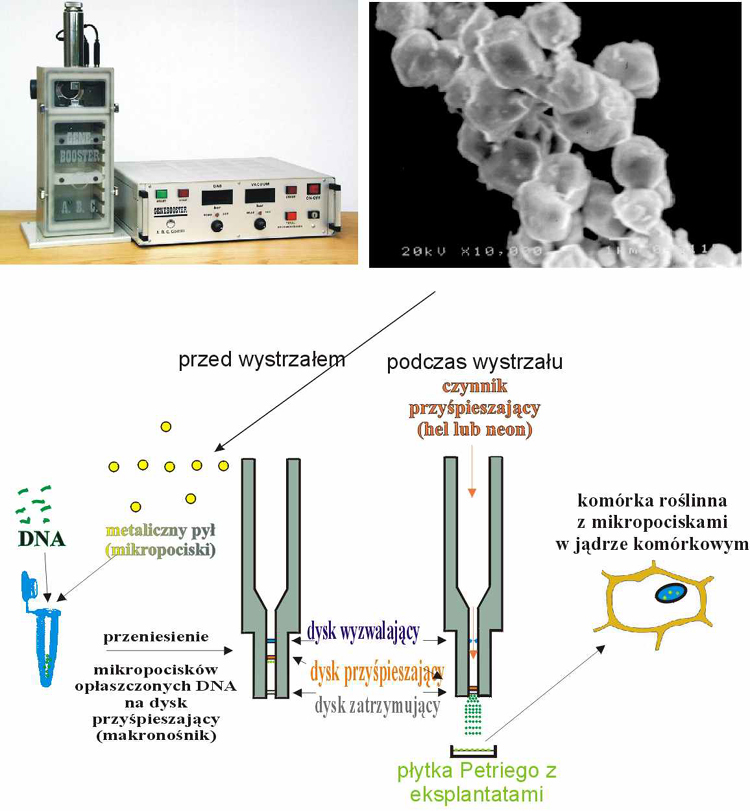
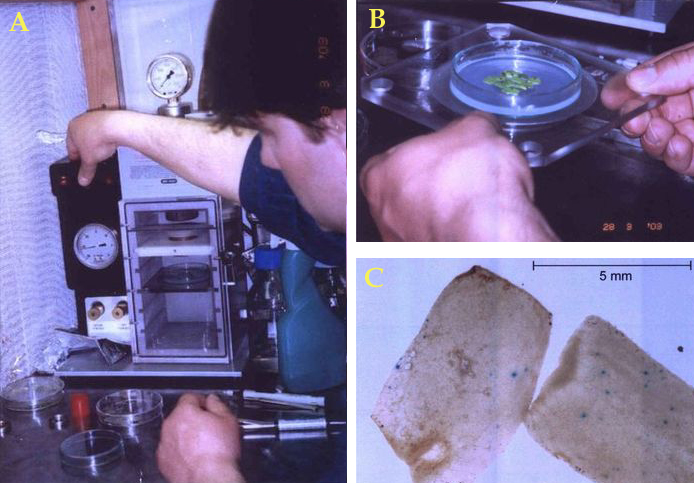
Mikrowstrzeliwanie jest metodą bezpośredniej (bezwektorowej) transformacji, polegającą na wprowadzeniu do komórek metalowego pyłu, którego cząstki - wielkości około 0,5 μm do kilku mikrometrów - oblepione są łańcuchami DNA, rzadziej RNA, a sporadycznie nawet całymi komórkami sinic. Metal, którego cząstki wykorzystuje się jako swego rodzaju mikropociski, dobrany jest tak, aby wykazywał możliwie najniższą aktywność fizjologiczną w komórkach i w związku z tym w możliwie najmniejszym stopniu zakłócał ich działanie. Najczęściej wykorzystuje się więc pył wolframowy lub złoty, dużo rzadziej paladowy, platynowy lub irydowy. W metodzie tej, nazywanej czasem biolistyczną (od "biologia + balistyka") wykorzystuje się urządzenie zwane armatką genową albo strzelbą genową (ryc. 1, 2). Jej głównym elementem jest hermetycznie zamykana komora, w której można umieścić płytkę Petriego z materiałem biologicznym (na agarowej pożywce), a następnie wypompować powietrze, znacznie obniżając w ten sposób ciśnienie (do ok. 0,02 atm). W górnej części komory znajduje się dysza, którą można doprowadzić pod dużym ciśnieniem (do ok. 150 atm) obojętny fizjologicznie gaz np. hel lub neon (w literaturze zachodniej ciśnienie wyrażane jest zwykle w funtach na cal kwadratowy, tj. psi; 1 atm = 14,696 psi; http://www.onlineconversion.com). Dysza zamykana jest plastykową płytką (dyskiem wyzwalającym), która pęka gdy ciśnienie gazu przekroczy określoną wartość (ok. 30 do 150 atm; zwykle ok. 100 atm - można wypróbować różne dyski), co zapoczątkowuje gwałtowne rozprężanie się gazu ("wystrzał"). Pod dyskiem wyzwalającym umieszcza się podobną płytkę - dysk przyspieszający (czyli płytkę wyrzutową zwaną też makronośnikiem), na którego powierzchnię nanosi się wymieszaną starannie z DNA zawiesinę metalowych mikropocisków. Gdy pęknie dysk wyzwalający, dysk przyspieszający jest porywany przez strumień gwałtownie rozprężającego się gazu i przelatuje odległość kilku do kilkunastu milimetrów, po czym zostaje gwałtownie wyhamowany przez dysk zatrzymujący (pierścień zatrzymujący). Ten pierścień nie stanowi żadnej bariery dla oblepionych łańcuchami DNA mikropocisków, które odrywają się od dysku przyspieszającego i pędzą w strumieniu gazu do tkanki położonej o kilka centymetrów niżej (tę odległość można zwykle ustawiać, podobnie jak ciśnienie gazu, dobierając w ten sposób optymalne warunki transformacji). Mikropociski rozpędzone do dużych prędkości, rzędu kilku m/s, przelatują przez ściany komórkowe i wbijają się do wnętrza komórek. Następnie eksplantaty poddawane są zwykle hodowli in vitro. Na dalsze losy "ładunku" (DNA) przeniesionego przez mikropociski eksperymentator nie ma wpływu, ale okazuje się, że ulega on często wbudowaniu do roślinnego genomu.
W metodzie biolistycznej następujące czynniki mogą wpływać na wydajność transformacji i wymagają optymalizacji:
- rodzaj stosowanych mikropocisków - ich wielkość i rodzaj metalu
- czynniki wspomagające opłaszczanie cząstek metalu przez DNA (spermidyna, chlorek wapnia; DNA wytrąca się etanolem w obecności metalowego pyłu i powyższych substancji),
- czynniki biologiczne - rodzaj tkanki poddawanej transformacji, etap cyklu komórkowego, stan osmotyczny tkanki, warunki wzrostu rośliny, z której pobierane są eksplantaty
Metoda biolistyczna pozwala na przezwyciężenie trudności napotykanych w przypadku metod dla niej konkurencyjncych - ograniczonego (choć bardzo szerokiego) zakresu patogeniczności Agrobacterium i trudności w regenerowaniu roślin z transformowanych protoplastów (protoplasty można transformować praktycznie każdą metodą, ale najczęściej używa się omówionych niżej metod elektroporacji i transformacji chemicznej). Transformacja biolistyczna ma szczególnie duże znaczenie w odniesieniu do roślin jednoliściennych, przy których jak wspomniano, stosowanie Agrobacterium bywa zawodne. Metodą biolistyczną transformowano już m.in. wszystkie gatunki zbóż oraz trzcinę cukrową i tulipana, a z dwuliściennych także soję i fasolę - rośliny, których transformowanie sprawiało początkowo duże trudności. Najczęściej transformacji biolistycznej poddaje się niedojrzałe zarodki, kalus embriogenny i zawiesinę komórkową. Metoda biolistyczna wykorzystywana jest też w próbach adresowania transgenów do plastydów (jak wspomniano wyżej, ze względu na obecność sygnału NLS w niektórych czynnikach wirulencji, transgeny przenoszone przez Agrobacterium trafiają do jądra komórkowego). Warunkiem zastosowania tej metody transformacji jest jednak posiadanie kosztownego sprzętu (choć ostatnio pojawiają się uproszczone i - nieco! - tańsze wersje strzelby genowej - ryc. 3). Czynnikiem ograniczającym wydajność transformacji biolistycznej może być niska przeżywalność komórek, spowodowana bezpośrednimi uszkodzeniami mechanicznymi oraz szokiem akustycznym. Rozkład trajektorii mikropocisków nie jest z zasady idealnie równomierny, co prowadzi do śmierci komórek w jednych punktach, zbyt intensywnie "ostrzelanych", i do całkowitego braku transgenów w innych. Większość cząstek nośnika dociera na głębokość zaledwie kilku pierwszych warstw komórek, a tkanki głębiej położone nie ulegają transformacji. Mankamentem metody jest też fakt, że wykorzystuje się tu łańcuchy DNA rozmieszczone na powierzchni metalowych mikropocisków przebijających się przez komórkowe ściany. Cząsteczki DNA narażone są więc na rozrywanie, dlatego w metodzie tej, częściej niż w przypadku zastosowania Agrobacterium, otrzymuje się transformanty zawierające niepełne, uszkodzone konstrukty. Częściej też niż w przypadku Agrobacterium otrzymuje się transformanty, których komórki wbudowują do genomu nie pojedyncze, ale liczne kopie transgenu, a to może uaktywnić komórkowe reakcje wyciszenia transgenów (ich wyłączenia).

| 5.5 Metoda mikroiniekcji |